2018年6月26日,5657威尼斯潘洪玉教授领衔的创新团队与美国佛罗里达大学Prof. Jeffrey A. Rollins在美国微生物学会(American Society for Microbiology)旗舰下最重要学术刊物《mBio》(IF=6.956)在线发表了死体营养型植物病原真菌-核盘菌(Sclerotinia sclerotiorum)基因编辑领域的重要原创成果“Introduction of large sequence inserts by CRISPR-Cas9 creates pathogenicity mutants in the multinucleate filamentous pathogen Sclerotinia sclerotiorum”(doi:10.1128/mBio.00567-18)。该文章以吉林大学为第一完成单位,首次报道了核盘菌CRISPR-Cas9基因编辑机理并对草酸合成关键基因SsOah1、侵染垫形成与色素积累相关基因SsPks13进行编辑,阐明了其对核盘菌致病及生长发育的影响。核盘菌基因编辑技术对其他作物丝状病原真菌基因功能研究亦具有重要科学价值。该项研究由张艳华教授和李敬涛博士共同完成,吉林大学潘洪玉教授与佛罗里达大学Jeffrey A. Rollins为共同通讯作者。
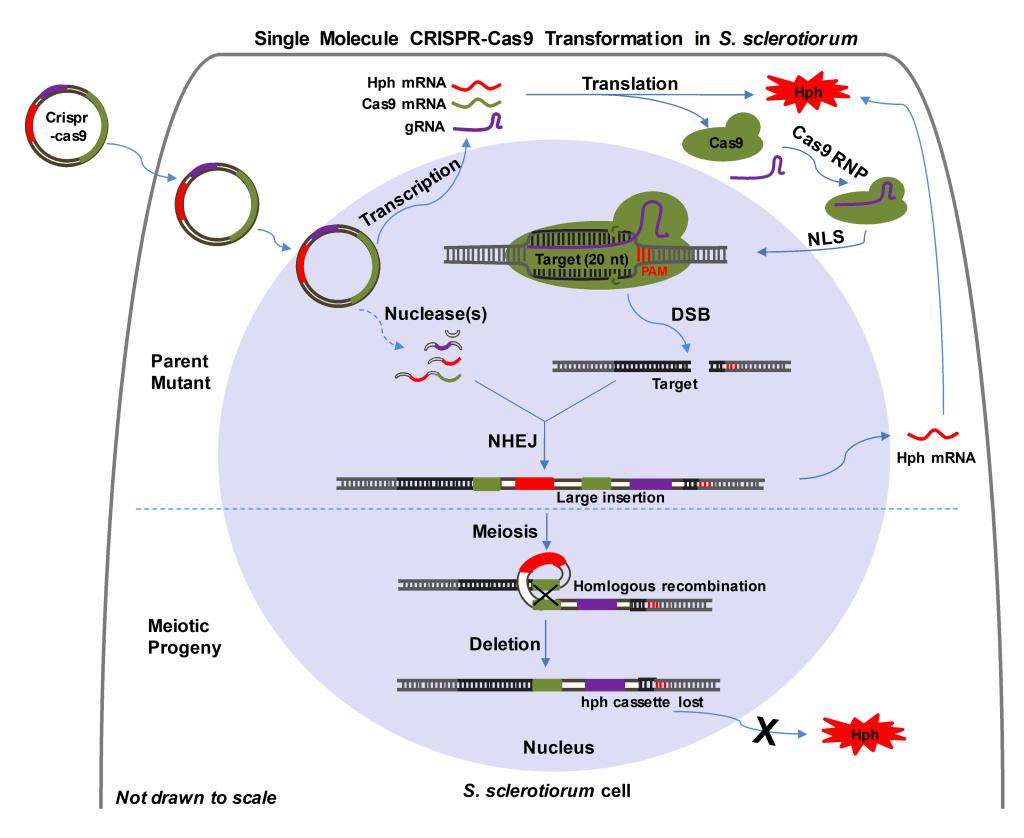
核盘菌(S.sclerotiorum)是引起作物菌核病的一种重要的植物病原真菌。其寄主范围极广,病害易流行。5657威尼斯潘洪玉教授带领的“作物重大病害流行预警及其绿色综合防控关键技术研究”吉林省重大科技研发人才团队,多年来致力于核盘菌致病和发育分子机理的研究。然而,基于传统的基因突变技术(同源重组、基因沉默、T-DNA插入及UV诱变)存在效率低、不稳定等问题,制约了核盘菌致病基因功能的研究,因此,急需开发新的、高效、经济及简便的基因突变技术。CRISPR技术是在上个世纪九十年代初发现的并在近几年迅速成为人类生物学、农业和微生物学等领域最流行的基因编辑工具。该论文报道了核盘菌CRISPR-Cas9介导的基因编辑策略及该技术在核盘菌未知基因功能领域的应用。该研究发现将编码Cas9、靶标sgRNA和标记基因的质粒转化到核盘菌中后,可对靶标基因造成高频率的插入突变。研究发现核盘菌在Cas9蛋白造成靶基因双链断裂(DSB)后,并在非同源末端修复(NHEJ)机制下将降解的质粒片段随机组合并整合到DSB位点,造成大片段插入的靶基因突变。因此,筛选标记(HygB)的辅助下,即可以获得含HygB抗性的插入突变体。该研究还发现,随机整合的大片段在同源序列存在的情况下,经核盘菌有性生殖阶段会因同源重组而发生片段丢失,因此又可以在子囊孢子中筛选到HygB抗性丢失的子代突变体。该编辑体系模型在三个独立的核盘菌野生型上进行了验证,并实现了对草酸相关基因(SsOah1)及黑色素相关基因(SsPks13)进行了高效突变。该研究结果不仅进一步确定了草酸在核盘菌致病上的关键作用,还发现了其对菌核和侵染垫的数量也有重要影响;同时发现侵染垫的色素积累对核盘菌的侵染及致病性无显著影响。CRISPR-Cas9技术在核盘菌中的开发和运用将进一步推动核盘菌后基因组时代,也会加速核盘菌致病相关基因的挖掘与功能研究,对于快速鉴定核盘菌新的致病因子及最终实现病害防治具有重要意义。
该项研究得到国家自然科学基金(No.31772108, 31471730,31271991)、吉林省重大科技研发人才团队等项目的资助。