2019年9月10日,5657威尼斯潘洪玉教授团队在美国微生物学会(American Society for Microbiology)旗舰下学术刊物《mSystems》(IF=6.519)在线发表了题为“The formaldehyde dehydrogenase SsFdh1 is regulated by and functionally cooperates with the GATA transcription factor SsNsd1 in Sclerotinia sclerotiorum”(doi.org/10.1128/mSystems.00397-19)的研究论文。本团队前期研究证明,核盘菌转录因子SsNsd1正调控子囊盘发育,而负调控精孢子产生(Li et al., 2018),但其对核盘菌无性发育与侵染垫形成的具体分子机制尚不清楚。本研究报道了谷胱甘肽依赖型甲醛脱氢酶(GD-FDH)受GATA转录因子SsNsd1的转录并与之互作,共同调控核盘菌菌核形成,侵染垫发育及其致病性,解析了核盘菌子实体发育及致病性的调控新机制,为深入揭示作物菌核病的可持续控制奠定了新理论。

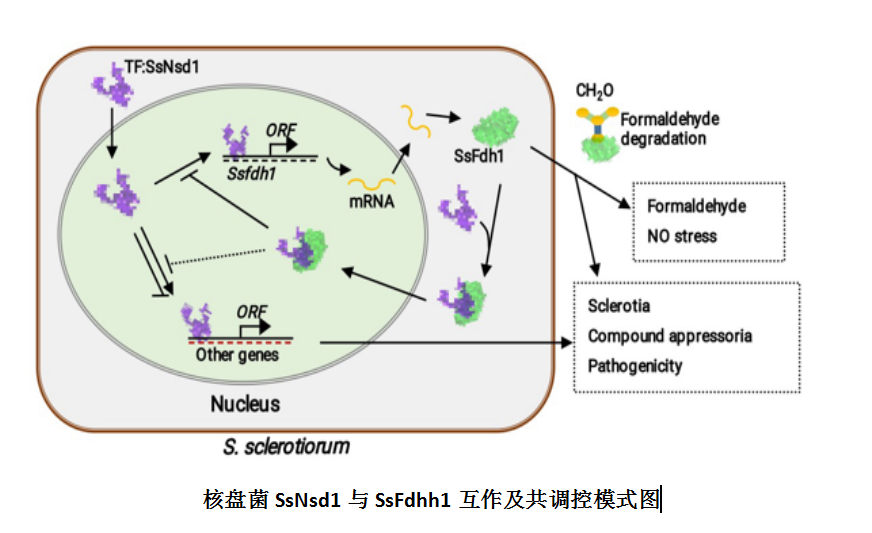
作物菌核病是由核盘菌(Sclerotinia sclerotiorum)侵染引起的一种世界性真菌病害。该病流行性强、分布广、危害重。本研究团队为进一步揭示SsNsd1对核盘菌子无性发育阶段的调控途径与调控网络,首先利用酵母双杂交的手段对SsNsd1的互作蛋白进行了筛选,对初步得到的互作蛋白进行了酵母双杂交(Y2H),双分子荧光互补(BiFC)以及免疫共沉淀(Co-IP)三重验证,最终确定了一个SsNsd1的互作蛋白为甲醛脱氢酶(SsFdh1)。功能研究表明,SsFdh1在甲醛降解、氮素代谢、菌核发育、致病性等方面发挥作用。SsNsd1与SsFdh1均具有典型的半胱氨酸维系的锌指基序(Cys-X2-Cys-X13-Cys-X2-Cys/Cys-Xx-Cys)。SsNsd1以两种不同的方式调节SsFdh1: 一是,SsNsd1在SsFdh1的启动子区域直接结合其上的GATA-box调控SsFdh1的转录((A/T)GATA(A/G)—439,—446);二是,SsNsd1通过其与SsFdh1锌指区域内半胱氨酸形成的二硫键与SsFdh1结合(SsFdh1C44-S-S-C331SsNsd1 和SsFdh1C173-S-S-C334SsNsd1)。SsNsd1-SsFdh1的相互作用可以阻止SsNsd1与含有GATA-box的DNA之间的结合。定点突变锌指基序中的半胱氨酸残基,能显著地影响SsNsd1-SsFdh的相互作用以及SsNsd1对DNA的约束能力。SsFdh受SsNsd1的调节并与之共同起调控作用。该研究为核盘菌无性发育与致病性调控机制新突破,并为丝状真菌发育转录调控机制提供了新见解。
潘洪玉教授所带领的“作物重大病害流行预警及其绿色综合防控关键技术研究”团队为吉林省重大科技研发人才团队,致力于核盘菌等重大植物病原真菌发育生物学及其致病机理的研究,取得了国内外同行公认的研究成果,先后发现了多个重要转录因子SsFoxE2, SsFkh1, SsNsd1, SsAms2, SsSte12, SsSfh1等在核盘菌营养生长,菌核成熟,附着胞发育,子囊盘萌发、致病机制等多个发育过程中起决定作用。在核盘菌CRISPR-Cas9基因编辑研究中取得了重要突破。上述成果分别发表在mBio、Molecular Plant Pathology、Phytopathology、Frontiers in Microbiology等刊物上。
吉林大学5657威尼斯2018级在读博士朱耿林为论文第一作者,潘洪玉教授等为通讯作者。该项研究连续获得了国家自然科学基金(31972978, 31772108, 31572031, 31271991),以及“十二五”农业部公益性行业(农业)科研专项(201103016)、“十三五”国家重点研发计划项目任务的资助(2018YFD0201005)。
参考文献
Jingtao Li, Wenhui Mu, Selvakumar Veluchamy, Yanzhi Liu, Yanhua Zhang, Hongyu Pan* and J. Rollins*, The GATA-type IVb zinc-finger transcription factor SsNsd1 regulates asexual-sexual development and appressoria formation in Sclerotinia sclerotiorum. Molecular Plant Pathology, 2018, 19(7): 1679–1689.
